Cytori Cell TherapyTMとは?

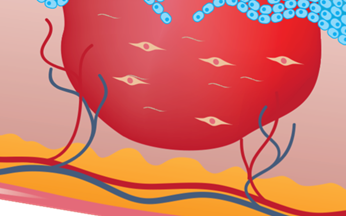
サイトリ・セラピューティクスが開発する細胞治療は、患者さんの皮下脂肪内に存在する細胞特有の性質を利用した治療で、その細胞は脂肪組織由来再生(幹)細胞-Adipose-Derived Regenerative Cells (ADRCs) と呼ばれています。
ADRCsとは、サイトリの特許技術のプラットフォームであるセルーションシステムを用いて抽出される多様な細胞で構成される非培養の有核細胞集団の総称で、Cytori Cell TherapyTMは、このADRCsを用い、細胞を抽出したその日のうちに患者さんに投与する治療です。
Cytori Cell TherapyTMは、損傷した組織の修復や機能維持、症状の進行を遅らせることが期待されます。
なぜ患者さまご自身の脂肪組織を用いるのでしょうか?
脂肪組織内にある幹細胞は、骨髄に含まれる幹細胞と比べて2,500倍もの量が含まれていることが、さまざまな研究により実証されています1,2,3。さらに、皮下脂肪は骨髄よりも低侵襲で採取しやすく、少量の脂肪吸引で細胞を採取することが可能です20。
サイトリの技術では、成人患者さんご自身の脂肪組織のみを用いてADRCsを調製するため、この細胞を用いた治療では、拒絶反応や疾患の伝播など、移植の際に起こりうる一般的な問題を回避することができ、拒絶反応抑制剤や免疫抑制剤を用いる必要がありません。
どのように作用するのでしょうか?
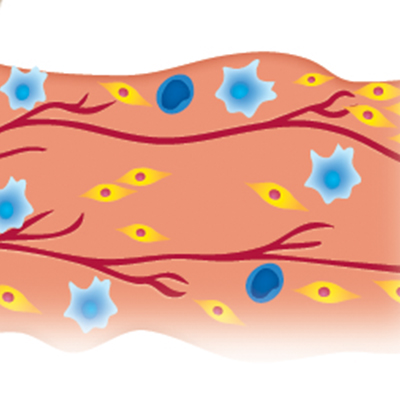
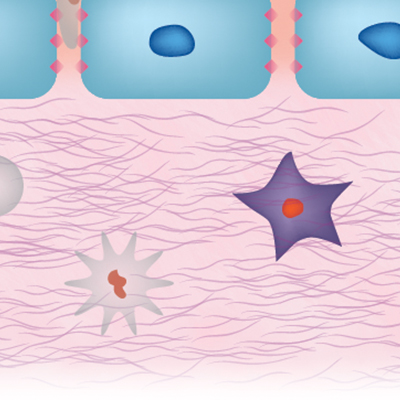
正確な作用機序は解明されていない部分もありますが、前臨床試験の論文において、ADRCsが血管新生、炎症および線維化の改善に関連していることが示唆されています4-14。
血管新生/血管障害
炎症コントロール
炎症
繊維化/組織修復
線維化/組織修復
多くの試験では、培養した脂肪組織由来幹細胞(ADSCs)についても報告されています。 細胞培養の場合、脂肪組織由来幹細胞は間質血管細胞群からさらに分離され、人工的な環境下で一定の細胞数に達するまで培養されます。
−般的な細胞培養プロセス
- プラスチックへの接着能力がある細胞が、ADSCsとして間質血管細胞群から分離されます。 このとき、非接着性の間質細胞および血管細胞は洗い流されます。
- 残ったADSCsは新鮮な組織培養培地に固定され、数日間培養されます(基質全体に幹細胞が密集するまで増殖させます)。
- この時点で、細胞の二次培養を行うため、新鮮な組織培養培地を入れた新たな容器に細胞を移してさらなる増殖のためのスペースを作る必要があります。 これは継代といわれ、数週間にわたり複数回繰り返し行われます。
ADRCsとADSCsの比較
| ADRCs | ADSCs | |
|
ありのままの細胞
|
人工的に培養した細胞
|
|
|
リアルタイム
|
生物学的な老化
|
|
|
自動化された操作
|
手作業による操作
|
|
|
日帰り細胞治療
|
時間のかかるプロセス
|

患者さんに利便性の高い先進技術
Cytori Cell TherapyTMは、一度の手術でADRCs投与まで実施でき、治療のために複数回通院をしなくてもよいようデザインされています。

日帰り細胞治療
Cytori Cell TherapyTMでは、院外の細胞加工施設に細胞を輸送する必要がありません。細胞の採取から処理までが院内で完結するため、より速やかな治療が可能となります。
安全性
世界中で実施されている複数の臨床試験において、多くの患者さんがADRCsによる治療を受けてきました。サイトリの細胞治療は、患者さんご自身の細胞を使用するため、拒絶反応リスクが回避されます。
- 1. Caplan 2009. Why are MSCs Therapeutic? New Data: New Insight. J. Pathol; 318-324
- 2. Fraser 2007. Differences in stem and progenitor cell yield in different subcutaneous adipose tissue depots, ISCT Vol 9, No 5 459-467.
- 3. Jurgens, 2008. Adipose tissue derived stem cell yield is affected by the tissue harvesting site: implications for cell based therapies, Cell and Tissue Research
- 4. Foubert P, Gonzalez A, Teodosescu S, Berard F, et al. Adipose-derived regenerative cell therapy for burn wound healing: a comparison of two delivery methods. Adv Wound Care. 2015;4(11). http://online.liebertpub.com/doi/abs/10.1089/wound.2015.0672?journalCode=wound
- 5. Koh Y, Koh B, Kim H, Joo H, et al. Stromal vascular fraction from adipose tissue forms profound vascular network through the dynamic reassembly of blood endothelial cells. Arterioscler Thromb Vasc Biol. 2011;31(5):1141-50. doi: 10.1161/ATVBAHA.110.218206.
- 6. Premaratne G, Ma L, Fujita M, Lin X, et al. Stromal vascular fraction transplantation as an alternative therapy for ischemic heart failure: anti-inflammatory role. J Cardiothorac Surg. 2011;6:43. doi: 10.1186/1749-8090-6-43.
- 7. Morris M, Beare J, Reed R, Dale J, et al. Systemically delivered adipose stromal vascular fraction cells disseminate to peripheral artery walls and reduce vasomotor tone through a CD11b+ cell-dependent mechanism. Stem Cell Transpl Med. 2015;4(4): 369-80. doi: 10.5966/sctm.2014-0252.
- 8. Eguchi M, Ikeda S, Kusumoto S, Sato D, et al. Adipose-derived regenerative cell therapy inhibits the progression of monocrotaline-induced pulmonary hypertension in rats. Life Sci. 2014;118(2):306-12. doi: 10.1016/j.lfs.2014.05.008.
- 9. Feng Z, Ting J, Alfonso Z, Strem B, et al. Fresh and cryopreserved, uncultured adipose tissue-derived stem and regenerative cells ameliorate ischemia-reperfusion-induced acute kidney injury. Nephrol Dial Transpl. 2010;25(12):3874-84. doi: 10.1093/ndt/gfq603.
- 10. Hao C, Shintani S, Shimizu Y, Kondo K, et al. Therapeutic angiogenesis by autologous adipose-derived regenerative cells: comparison with bone marrow mononuclear cells. Am J Physiol Heart and Circ Physiol. 2014;307(6): H869-79. doi: 10.1152/ajpheart.00310.2014.
- 11. Dong Z, Peng Z, Chang Q. The survival condition and immunoregulatory function of adipose stromal vascular fraction (SVF) in the early stage of nonvascularized adipose transplantation. PLos One. 2013;8(11): e80364. doi: 10.1371/journal.pone.0080364.
- 12. Baulier E, et al. Characterization of the porcine Stromal Vascular Fraction (SVF) and evaluation of the therapeutic potential in order to use in a preclinical model of porcine kidney transplantation. Data on file (Cytori).
- 13. Serratrice N, Bruzzese L, Magalon J, Véran J, et al. New fat-derived products for treating skin-induced lesions of scleroderma in nude mice Stem Cell Res Ther. 2014;5(6):138. doi: 10.1186/scrt528.
- 14. Boissier R, Karsenty G. Réunion de travail tissu graisseux-fraction vasculaire stromale. Applications en urologie incontinence urinaire. Data on file (Cytori).
- 15. Granel B, Daumas A, Jouve E, Harlé J. et al. Safety, tolerability and potential efficacy of injection of autologous adipose-derived stromal vascular fraction in the fingers of patients with systemic sclerosis: an open-label phase I trial. Ann Rheum Dis. 2014;0:1–8. doi: 10.1136/annrheumdis-2014-205681.
- 16. Guillaume-Jugnot P, Daumas A, Magalon J, Jouve E, et al. Autologous adipose-derived stromal vascular fraction in patients with systemic sclerosis: 12-month follow-up. Rheumatol. 2016:55(2):301-6. doi: 10.1093/rheumatology/kev323.
- 17. Gotoh M, Yamamoto T, Kato M, Majima T, et al. Regenerative treatment of male stress urinary incontinence by periurethral injection of autologous adipose-derived regenerative cells: 1-year outcomes in 11 patients. Intl J Urol. 2014;21(3):294-300. doi: 10.1111/iju.12266.
- 18. Perez-Cano R, Vranckx J, Lasso J, Calabrese C, et al. Prospective trial of adipose-derived regenerative cell (ADRC)-enriched fat grafting for partial mastectomy defects: the RESTORE-2 trial. Eur J Surg Onc. 2012;38(5): 382-9. doi: 10.1016/j.ejso.2012.02.178.
- 19. Daumas, A. et al. “Long-term follow-up after autologous adipose-derived stromal vascular fraction injection into fingers in systemic sclerosis patients.” Current Research in Translational Medicine. 2016.
- 20. Fraser J, Wulur I, Alfonso Z, Hedrick M. Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol. 2006 Apr;24(4):150-4. Epub 2006 Feb 20. Review.
- 21. Zuk P, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001 Apr;7(2):211-28.
- 20. Fraser J, Wulur I, Alfonso Z, Hedrick M. Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol. 2006 Apr;24(4):150-4. Epub 2006 Feb 20. Review.
- 21. Zuk P, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP, Hedrick MH. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001 Apr;7(2):211-28.
受賞歴
サイトリは、10年以上にわたる再生医療領域での発展を認められ、フロスト&サリバン社の2016年北米細胞治療技術革新賞(2016 North American Cell Therapeutics Technology Innovation Award)を受賞しました。

フロスト&サリバン社の産業研究およびベンチマーク分析では、サイトリの先駆的な技術プラットフォームが、ADRCsを用いた細胞治療の研究と臨床応用を可能にする先進技術となったと報告されています。詳細な報告書全文は、 こちら からご覧いただけます。
特許
論文
前十字靱帯修
- Cugat R et al. Biological Augmentation of ACL Reconstruction [abstract]. In: The Orthobiologic Institute (TOBI) 7th Annual PRP & Regenerative Medicine Symposium with Cadaver Lab.; 2016 Jun 10 – 12; Las Vegas, NV. Healthy Aging Research; 2017. Abstract nr 2.
急性腎障害
- Feng Z et al. Fresh and cryopreserved, uncultured adipose tissue-derived stem and regenerative cells ameliorate ischemia-reperfusion-induced acute kidney injury. Nephrol Dial Transplant. 2010 Dec;25(12):3874-84. doi: 10.1093/ndt/gfq603.
毛髪再生
- Perez-Meza D et al. Hair follicle growth by stromal vascular fraction-enhanced adipose transplantation in baldness. Stem Cells Cloning. 2017 Jul 6;10:1-10. doi: 10.2147/SCCAA.S131431. eCollection 2017.
骨再生
- Prins H et al. Bone Regeneration Using the Freshly Isolated Autologous Stromal Vascular Fraction of Adipose Tissue in Combination With Calcium Phosphate Ceramics. Stem Cells Transl Med. 2016 Oct;5(10):1362-1374.
- Saxer F et al. Implantation of Stromal Vascular Fraction Progenitors at Bone Fracture Sites: From a Rat Model to a First-in-Man Study. Stem Cells. 2016 Dec;34(12):2956-2966. doi: 10.1002/stem.2478.
- Lendeckel S et al. Autologous stem cells (adipose) and fibrin glue used to treat widespread traumatic calvarial defects: case report. J Craniomaxillofac Surg. 2004 Dec;32(6):370-3.
乳房再建・豊胸
- Calabrese C et al. Breast reconstruction after nipple/areola-sparing mastectomy using cell-enhanced fat grafting. Ecancermedicalscience. 2009;3:116. doi: 10.3332/ecancer.2009.116.
- Domenis R et al. Adipose tissue derived stem cells: in vitro and in vivo analysis of a standard and three commercially available cell-assisted lipotransfer techniques. Stem Cell Res Ther. 2015 Jan 5;6:2. doi: 10.1186/scrt536.
- Gentile P et al. A comparative translational study: the combined use of enhanced stromal vascular fraction and platelet-rich plasma improves fat grafting maintenance in breast reconstruction. Stem Cells Transl Med. 2012 Apr;1(4):341-51. doi: 10.5966/sctm.2011-0065.
- Gentile P et al. Breast Reconstruction with Enhanced Stromal Vascular Fraction Fat Grafting: What Is the Best Method? Plast Reconstr Surg Glob Open. 2015 Jul 8;3(6):e406. doi: 10.1097/GOX.0000000000000285. eCollection 2015 Jun.
- Ito S et al. Long-term outcome of adipose-derived regenerative cell-enriched autologous fat transplantation for reconstruction after breast-conserving surgery for Japanese women with breast cancer. Surg Today. 2017 Dec;47(12):1500-1511. doi: 10.1007/s00595-017-1544-4.
- Kamakura T et al. Autologous cell-enriched fat grafting for breast augmentation. Aesthetic Plast Surg. 2011 Dec;35(6):1022-30. doi: 10.1007/s00266-011-9727-7.
- Pérez-Cano R et al. Prospective trial of adipose-derived regenerative cell (ADRC)-enriched fat grafting for partial mastectomy defects: the RESTORE-2 trial. Eur J Surg Oncol. 2012 May;38(5):382-9. doi: 10.1016/j.ejso.2012.02.178.
- Sugimachi K et al. “Novel breast reconstruction procedure- Attempts of breast regeneration using stem cells after breast cancer mastectomy.” Japan Journal of Cosmetic Surgery, 30(3); 151-160; 2008.
- Tiryaki T et al. Staged stem cell-enriched tissue (SET) injections for soft tissue augmentation in hostile recipient areas: a preliminary report. Aesthetic Plast Surg. 2011 Dec;35(6):965-71. doi: 10.1007/s00266-011-9716-x.
- Tsekouras A et al. Adipose-derived stem cells for breast reconstruction after breast surgery – preliminary results. Case Reports Plast Surg Hand Surg. 2017 Apr 19;4(1):35-41. doi: 10.1080/23320885.2017.1316201. eCollection 2017.
熱傷
- Arkoulis N et al. Stem cell enriched dermal substitutes for the treatment of late burn contractures in patients with major burns. Burns. 2018 May;44(3):724-726. doi: 10.1016/j.burns.2017.09.026.
- Foubert P et al. Preclinical assessment of safety and efficacy of intravenous delivery of autologous adipose-derived regenerative cells (ADRCs) in the treatment of severe thermal burns using a porcine model. Burns. 2018 Jun 26. pii: S0305-4179(18)30364-4. doi: 10.1016/j.burns.2018.05.006.
慢性創傷
- Akita S et al. Autologous adipose-derived regenerative cells are effective for chronic intractable radiation injuries. Radiat Prot Dosimetry. 2012 Oct;151(4):656-60.
- Akita S et al. Noncultured autologous adipose-derived stem cells therapy for chronic radiation injury. Stem Cells Int. 2010 Dec 1;2010:532704. doi: 10.4061/2010/532704.
- Andjelkov K et al. A novel method for treatment of chronic anal fissure: adipose-derived regenerative cells – a pilot study. Colorectal Dis. 2017 Jun;19(6):570-575. doi: 10.1111/codi.13555.
- Andjelkov K et al. Posterior Fourchette Fissure Resolution After Injection of Autologous Adipose-Derived Regenerative Cells. Obstet Gynecol. 2017 Mar;129(3):497-499. doi: 10.1097/AOG.0000000000001906.
- Cervelli V et al. Application of enhanced stromal vascular fraction and fat grafting mixed with PRP in post-traumatic lower extremity ulcers. Stem Cell Res. 2011 Mar;6(2):103-11. doi: 10.1016/j.scr.2010.11.003.
- Iddins C et al. Case Report: Industrial X-Ray Injury Treated With Non-Cultured Autologous Adipose-Derived Stromal Vascular Fraction (SVF). Health Phys. 2016 Aug;111(2):112-6. doi: 10.1097/HP.0000000000000483.
- Karaaltin M et al. Adipose Derived Regenerative Cell Therapy for Treating a Diabetic Wound: A Case Report. Wounds. 2012 Jan;24(1):e1-5.
- Marino G et al. Therapy with autologous adipose-derived regenerative cells for the care of chronic ulcer of lower limbs in patients with peripheral arterial disease. J Surg Res. 2013 Nov;185(1):36-44. doi: 10.1016/j.jss.2013.05.024.
- Yoshimoto H et al. “Efficacy of patients’ own adipose-derived regenerative cells for chronic intractable radiation injuries.” Journal of Wound Technology, 10; 22-25; 2010.
- Akita S et al. Mesenchymal stem cell therapy for cutaneous radiation syndrome. Health Phys. 2010 Jun;98(6):858-62. doi: 10.1097/HP.0b013e3181d3d52c.
勃起不全
- Haahr M et al. Safety and Potential Effect of a Single Intracavernous Injection of Autologous Adipose-Derived Regenerative Cells in Patients with Erectile Dysfunction Following Radical Prostatectomy: An Open-Label Phase I Clinical Trial. EBioMedicine. 2016 Jan 19;5:204-10. doi: 10.1016/j.ebiom.2016.01.024. eCollection 2016 Mar.
- Haahr M et al. Safety and Potential Effect of a Single Intracavernous Injection of Autologous Adipose-Derived Regenerative Cells in Patients with Erectile Dysfunction Following Radical Prostatectomy: A 12-Month Follow-Up. The Journal of Urology, 197:4; e542; 2017.
瘻孔
- Borowski D et al. Adipose Tissue-Derived Regenerative Cell-Enhanced Lipofilling for Treatment of Cryptoglandular Fistulae-in-Ano: The ALFA Technique. Surg Innov. 2015 Dec;22(6):593-600. doi: 10.1177/1553350615572656.
- Borowski D et al. Autologous adipose-tissue derived regenerative cells for the treatment of complex cryptoglandular fistula-in-ano: a report of three cases. BMJ Case Rep. 2012 Nov 9;2012. pii: bcr2012006988. doi: 10.1136/bcr-2012-006988.
- Foll et al. Successful closure of persistent oro-cutaneous fistulas by injection of autologous adipose-derived stem cells: a case report. GMS Ger Plast Reconstr Aesthet Surg. 2013;3:Doc05. DOI:10.3205/gpras000015,URN:urn:nbn:de:0183-gpras0000150
- Mizushima T et al. A clinical trial of autologous adipose-derived regenerative cell transplantation for a postoperative enterocutaneous fistula. Surg Today. 2016 Jul;46(7):835-42. doi: 10.1007/s00595-015-1246-8.
- Philandrianos C et al. First clinical case report of local microinjection of autologous fat and adipose-derived stromal vascular fraction for perianal fistula in Crohn’s disease. Stem Cell Res Ther. 2018 Jan 10;9(1):4. doi: 10.1186/s13287-017-0736-6.
心疾患
- Henry T et al. The Athena trials: Autologous adipose-derived regenerative cells for refractory chronic myocardial ischemia with left ventricular dysfunction. Catheter Cardiovasc Interv. 2017 Feb 1;89(2):169-177. doi: 10.1002/ccd.26601.
- Houtgraaf J et al. First experience in humans using adipose tissue-derived regenerative cells in the treatment of patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol. 2012 Jan 31;59(5):539-40. doi: 10.1016/j.jacc.2011.09.065.
- Perin E et al. Adipose-derived regenerative cells in patients with ischemic cardiomyopathy: The PRECISE Trial. Am Heart J. 2014 Jul;168(1):88-95.e2. doi: 10.1016/j.ahj.2014.03.022.
- Duckers H et al. The Bedside Celution system for isolation of adipose derived regenerative cells. EuroIntervention. 2006 Nov;2(3):395-8.
変形性膝関節症
- Smyshlyaev I et al. “Safety and Effectiveness of Intraarticular Administration of Adipose-Derived Stromal Vascular Fraction for Treatment of Knee Articular Cartilage Degenerative Damage: Preliminary Results of a Clinical Trial.” Traumatology and Orthopedics of Russia, 23:3; 17-31; 2017.
- Yokota N et al. “Clinical results following intra-articular injection of adipose-derived stromal vascular fraction cells in patients with osteoarthritis of the knee.” Regenerative Therapy, 6; 108-112; 2017.
肝硬変
- Sakai Y et al. “Phase I clinical study of liver regenerative therapy for cirrhosis by intrahepatic arterial infusion of freshly isolated autologous adipose tissue-derived stromal/stem (regenerative) cell.” Regenerative Therapy, 6; 52-64; 2017.
リンパ浮腫
- Toyserkani N et al. Treatment of Breast Cancer-Related Lymphedema with Adipose-Derived Regenerative Cells and Fat Grafts: A Feasibility and Safety Study. Stem Cells Transl Med. 2017 Aug;6(8):1666-1672. doi: 10.1002/sctm.17-0037.
- Toyserkani N et al. Cell-Assisted Lipotransfer Using Autologous Adipose-Derived Stromal Cells for Alleviation of Breast Cancer-Related Lymphedema. Stem Cells Transl Med. 2016 Jul;5(7):857-9. doi: 10.5966/sctm.2015-0357.
神経腫
- Calcagni M et al. The novel treatment of SVF-enriched fat grafting for painful end-neuromas of superficial radial nerve. Microsurgery. 2018 Mar;38(3):264-269. doi:10.1002/micr.30122.
形成再建外科
- Gentile P et al. Adipose-derived stromal vascular fraction cells and platelet-rich plasma: basic and clinical evaluation for cell-based therapies in patients with scars on the face. J Craniofac Surg. 2014 Jan;25(1):267-72. doi: 10.1097/01.scs.0000436746.21031.ba.
- Herold et al. Supplementation of fat grafts with adipose-derived regenerative cells in reconstructive surgery. GMS Ger Plast Reconstr Aesthet Surg. 2012;2:Doc07. DOI:10.3205/gpras000009,URN:urn:nbn:de:0183-gpras0000099
- Kakudo N et al. Adipose-derived regenerative cell (ADRC)-enriched fat grafting: optimal cell concentration and effects on grafted fat characteristics. J Transl Med. 2013 Oct 10;11:254. doi: 10.1186/1479-5876-11-254.
- Karaaltin M et al. Treatment of “en coup de sabre” deformity with adipose-derived regenerative cell-enriched fat graft. J Craniofac Surg. 2012 Mar;23(2):e103-5. doi: 10.1097/SCS.0b013e3182418ce8.
強皮症
- Daumas A et al. Long-term follow-up after autologous adipose-derived stromal vascular fraction injection into fingers in systemic sclerosis patients. Curr Res Transl Med. 2017 Jan – Mar;65(1):40-43. doi: 10.1016/j.retram.2016.10.006.
- Granel B et al. Safety, tolerability and potential efficacy of injection of autologous adipose-derived stromal vascular fraction in the fingers of patients with systemic sclerosis: an open-label phase I trial. Ann Rheum Dis. 2015 Dec;74(12):2175-82. doi: 10.1136/annrheumdis-2014-205681.
- Guillaume-Jugnot P et al. Autologous adipose-derived stromal vascular fraction in patients with systemic sclerosis: 12-month follow-up. Rheumatology (Oxford). 2016 Feb;55(2):301-6. doi: 10.1093/rheumatology/kev323.
- Khanna D et al. Adipose-Derived Cell Therapy for Hand Dysfunction in Patients with Systemic Sclerosis: A Randomized, Double-Blind, Placebo-Controlled Trial. Paper presented at: 5th Systemic Sclerosis World Congress. 2018 Feb 15 – 17; Bordeaux, France.
- Magalon G et al. Regenerative Approach to Scleroderma with Fat Grafting. Clin Plast Surg. 2015 Jul;42(3):353-64, viii-ix. doi: 10.1016/j.cps.2015.03.009. Review.
腹圧性尿失禁
- Boissier R et al. Histological and Urodynamic Effects of Autologous Stromal Vascular Fraction Extracted from Fat Tissue with Minimal Ex Vivo Manipulation in a Porcine Model of Intrinsic Sphincter Deficiency. J Urol. 2016 Sep;196(3):934-42. doi: 10.1016/j.juro.2016.04.099.
- Choi J et al. Adipose-Derived Regenerative Cell Injection Therapy for Postprostatectomy Incontinence: A Phase I Clinical Study. Yonsei Med J. 2016 Sep;57(5):1152-8. doi: 10.3349/ymj.2016.57.5.1152.
- Gotoh M et al. Regenerative treatment of male stress urinary incontinence by periurethral injection of autologous adipose-derived regenerative cells: 1-year outcomes in 11 patients. Int J Urol. 2014 Mar;21(3):294-300. doi: 10.1111/iju.12266.
- Gotoh M et al. Long-term durability of efficacy and safety of regenerative treatment of male stress urinary incontinence using autologous adipose-derived regenerative cells [abstract]. In: ICS 2017.;2017 Sep 12 – 15; Florence, Italy. International Continence Society; 2017. Abstract nr 489.
- Shimizu S et al. Design of a single-arm clinical trial of regenerative therapy by periurethral injection of adipose-derived regenerative cells for male stress urinary incontinence in Japan: the ADRESU study protocol. BMC Urol. 2017 Sep 25;17(1):89. doi: 10.1186/s12894-017-0282-7.
- Yamamoto T et al. Periurethral injection of autologous adipose-derived regenerative cells for the treatment of male stress urinary incontinence: Report of three initial cases. Int J Urol. 2012 Jul;19(7):652-9. doi: 10.1111/j.1442-2042.2012.02999.x.
声帯修復
- Mattei A et al. Autologous adipose-derived stromal vascular fraction and scarred vocal folds: first clinical case report. Stem Cell Res Ther. 2018 Jul 27;9(1):202. doi: 10.1186/s13287-018-0842-0.
その他
- Aronowitz J et al. Adipose stromal vascular fraction isolation: a head-to-head comparison of four commercial cell separation systems. Plast Reconstr Surg. 2013 Dec;132(6):932e-9e. doi: 10.1097/PRS.0b013e3182a80652.
- Fraser J et al. The Celution® System: Automated Processing of Adipose-Derived Regenerative Cells in a Functionally Closed System. Adv Wound Care (New Rochelle). 2014 Jan 1;3(1):38-45.
- Kesten S et al. Autologous Adipose Derived Regenerative Cells: A Platform for Therapeutic Applications. Surg Technol Int. 2016 Oct 26;29:38-44.